郑州源创基因科技有限公司成立于2016年,由哥伦比亚大学博士后赵辉,归国创办的国家高新技术企业。拥有97项知识产权及实用技术,业务遍布上海、重庆、深圳、北京等城市,总部在郑州航空港区。
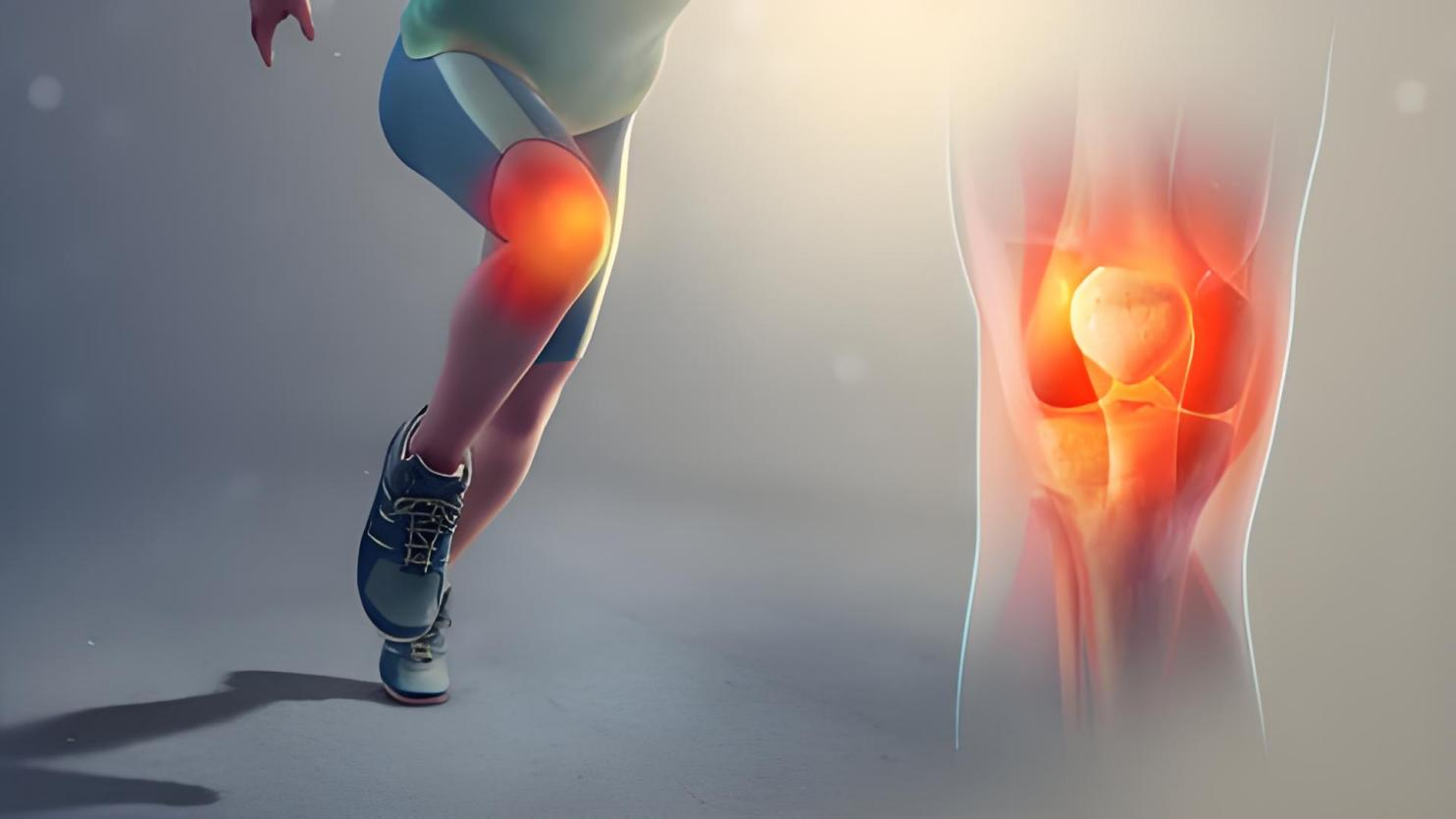
OA先前主要是关节软骨破坏,但越来越多的证据表明OA是一种伴有全关节损伤和功能障碍的疾病。在骨性关节炎进展过程中,关节的病理改变包括软骨损伤、软骨下骨重塑、滑膜炎症活化、韧带和半月板退变、关节囊、粘液囊、关节周围肌肉、神经和局部脂肪垫的改变。
外泌体被认为是参与许多生理和病理过程的细胞间通讯的重要介质。最近,外泌体在 OA 中的作用和治疗潜力在这一领域得到了越来越多的关注。
外泌体,细胞间通讯介质
细胞外囊泡 (EV) 是膜结合载体,可分为三种类型,包括外泌体、微囊泡 (MV) 和凋亡小体。作为一种重要的 EV,外泌体在过去十年中受到了最多的关注。外泌体可以由各种细胞分泌,并通过其内容物(包括脂质、核酸和蛋白质)介导细胞间通讯。
外泌体的直径通常在30-150 nm之间,密度在1.13-1.19 g·mL-1.19之间。发现脱落的膜囊泡可能具有生理功能,并建议将这些囊泡作为外泌体。1983 年,Harding 等人,观察到膜结合囊泡可以通过多囊泡内体 (MVE) 胞吐作用释放。1987 年,Johnstone 等人,观察到网织红细胞成熟过程中的外泌体释放与质膜活性有关。2007 年,Valadi 等人。发现 mRNA 和 microRNA 可以通过外泌体发送到其他细胞,表明外泌体可能通过递送核酸来介导细胞间通讯。此后,越来越多的研究表明外泌体通过介导细胞间通讯发挥重要的生理和病理作用。
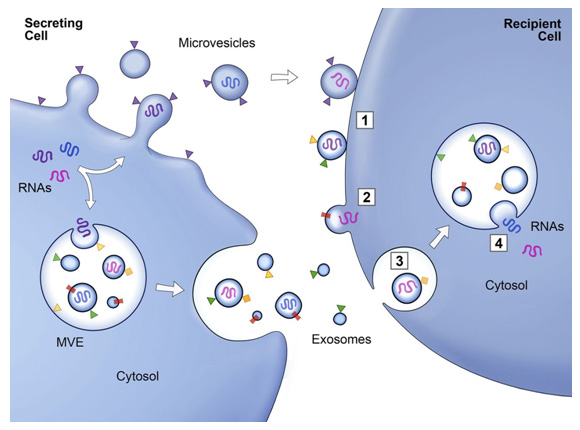
外泌体的产生过程
在人类关节腔中可检测到外泌体,并观察到随着 OA 的进展而发生变化。几种关节细胞,包括软骨细胞、滑膜成纤维细胞、成骨细胞和肌腱细胞,可以产生和分泌影响靶细胞生物学效应的外泌体。此外,来自干细胞的外泌体可以通过促进软骨修复、抑制滑膜炎和介导软骨下骨重塑来保护 OA 关节免受损伤。
干细胞衍生外泌体对OA的治疗效果
最近的研究报告称,外泌体作为一种新的细胞间通信手段,通过输送多种生物活性分子来创建一个调节软骨行为的特定微环境。具体而言,外泌体货物,如非编码RNA(ncRNA)和蛋白质,通过调节关节细胞的增殖、凋亡、自噬和炎症反应,在OA进展中发挥关键作用,使其成为OA监测和治疗的理想候选物。干细胞如骨髓间充质干细胞(BMSCs)和脂肪间充质干细胞(AMSCs)表现出有效的软骨再生能力,并已针对OA治疗的临床试验和临床测试。表现出可靠的安全性和可行性,而这种方法可以改善膝关节社会临床评级系统(KSS)和OA结果得分,并部分缓解膝关节疼痛。
来自骨髓间充质干细胞的外泌体
源自 BMSC 的外泌体可以影响细胞命运,包括细胞凋亡、增殖、侵袭和迁移。此外,源自 BMSC 的外泌体可以调节多种生理和病理过程,包括免疫反应、成骨、纤维化和血管生成。几项研究报告称,BMSC 衍生的外泌体显着促进受损组织的再生和修复,包括软骨和软骨下骨。来自 TGFβ3 预处理的 BMSC 的外泌体以及 MV/微粒 (MP) 显着增加了骨关节炎软骨细胞中合成代谢标记的表达并降低了分解代谢标记基因的水平。此外,这些 BMSC 衍生的外泌体可以防止骨关节炎软骨细胞发生细胞凋亡。
来自滑膜间充质干细胞的外泌体
滑膜间充质干细胞 (SMSC) 在体外显示出更好的软骨分化能力。研究发现来自 OA 或 RA 患者的 SMSCs 可以在体外和体内使用同种异体组织工程构建体有效增强软骨修复。在实验动物模型中,关节内注射 SMSCs 可以显着促进软骨修复并用于治疗关节相关疾病,包括 OA。此外,SMSC-140-Exo 治疗显着减轻了大鼠 OA 模型中的关节磨损,降低了 OARSI 评分并延迟了 OA 进展。
来自脂肪组织间充质干细胞的外泌体
脂肪组织间充质干细胞 (AMSCs) 被证明具有强大的软骨再生和炎症调节能力,被认为是 OA 治疗的极好细胞来源。然而,AMSC 诱导软骨再生的机制仍不清楚。越来越多的证据表明,AMSCs 可能主要通过旁分泌营养因子来调节局部微环境,从而防止软骨侵蚀并改善关节功能,使其更利于修复和再生。据报道,EVs,包括 MVs 和外泌体,主要介导 AMSCs 对骨关节炎成骨细胞的旁分泌作用。此外,AMSC 衍生的 MV 和外泌体可以抑制促炎介质的产生,如 TNF-α、IL-6、PGE2 和 NO,以及 MMP 活性和 MMP-13 水平,同时增加抗炎细胞因子 IL 的水平-10 和 OA 软骨细胞中的软骨细胞特异性分子胶原蛋白 II,209 这表明 AMSC 衍生的 MV 和外泌体具有潜在的抗炎和软骨保护作用。
最新成果:外泌体+支架,促进软骨损伤修复
中国医科大学附属第一医院李旭研究团队发现,脐源间充质干细胞外泌体(MSC-Exos)结合脱细胞软骨细胞外基质(ACECM)支架,可促进软骨缺损的再生修复。该研究发表于Bioactive Materials 杂志上:
本研究首次将脐源间充质干细胞外泌体与ACECM支架相结合,修复骨软骨缺损。本研究证实,间充质干细胞外泌体可以提高兔骨软骨缺损模型中ACECM支架的修复效果。这种作用可能是由于EXO促进内源性MSC和软骨细胞增殖、抑制关节腔内炎症,以及EXO和外泌体miRNA促进软骨ECM合成,从而实现的。
基于MSC-Exos和ACECM支架的“无细胞”组织工程策略是实现骨软骨再生的有效方法。鉴于来源于人软骨基质的ACECM支架已成功应用于临床,这种新型的“无细胞”组织工程软骨具有广阔的临床转化前景。
展望
作为一种重要的细胞间通讯介质,外泌体极大地促进了 OA 的发生和进展,并已显示出用于 OA 治疗的强大潜力。探索外泌体在 OA 病理变化中的详细机制将有助于我们筛选和识别潜在的治疗靶点。此外,我们需要优化 MSC-Exos 以提高其对 OA 的治疗效果。关于外泌体在 OA 中的作用、潜在机制和诊断/治疗应用的研究才刚刚开始,该领域仍有许多问题需要解决。随着技术的进步,我们坚信未来细胞外泌体将会广泛地应用于 OA 患者,发挥更大的骨关节炎治调理作用。
图片:来源于网络






